打开文本图片集
[摘要]目的 探讨肾血管平滑肌脂肪瘤的临床病理特征的诊断和判定。方法 选择2009年1月~2015年12月我院确诊的12例肾AML患者手术切除标本作为研究对象,通过光镜观察和免疫组织化学染色进行研究,鉴别及分析肾AML病理特征。结果 12例肾AML患者中,男3例,女9例,发病年龄31~57岁,平均(43.58±5.31)岁。发生于左肾5例,右肾7例;肾切除术5例,肿瘤剜除术7例;患者中8例获得随访,4例失访。病理组织学观察,本组中有3例,占比25%,主要由增生的上皮样平滑肌细胞组成,可有异型性,细胞呈片巢状或弥漫分布,可围绕血管呈套袖样排列。免疫组化表达:Vimentin、HMB 45、melan A和SMA呈弥漫阳性,CD117、CD34、CK、EMA、S-100、CgA阴性。结论 肾AML是一种少见的间叶源性肿瘤,治疗以手术切除为首选,通过光镜观察和免疫组化染色可帮助诊断与鉴别诊断,而EAML是一种具有恶性潜能的间叶源性肿瘤,其生物学行为有待进一步观察。
[关键词]血管平滑肌脂肪瘤;诊断;鉴别诊断
[中图分类号] R826.61 [文献标识码] A [文章编号] 1674-4721(2016)09(a)-0094-03
血管平滑肌脂肪瘤(angiomyolipoma,AML)是一种少见的间叶源性肿瘤,由平滑肌、血管和脂肪细胞混合构成,主要发生在肾脏[1]。因其病理形态多变,且良恶性诊断无明确界限,为了对AML的临床特征进行明确的诊断,以此降低误诊率,我院将发现的肾AML患者进行临床病理和免疫组化分析,对该肿瘤的临床病理特征、诊断与鉴别进行探讨。
1 资料与方法
1.1一般资料
收集2009年1月~2015年12月我院病理确诊为肾AML的手术切除标本12例,均有完整的临床资料和病理资料,其中8例获得随访,随访时间为8~75个月,4例失访。
1.2方法
所有标本经4%中性甲醛固定[2],常规脱水,石蜡包埋、4 μm切片、HE染色、显微镜观察。免疫组化采用SP法,抗Vimentin、CK、EMA、HMB45、MelanA、SMA、CgA、S-100、CD117、CD34和免疫试剂盒均购自北京中杉金桥生物技术有限公司。
2结果
2.1临床资料
共有12例肾AML患者,其中男3例,女9例,年龄31~57岁,平均(43.58±5.31)岁,其中7例具有腰部胀痛的现象,1例肉眼可见血尿,12例肾AML患者均经过CT及B超的相关检查拟诊为肾AML或肾结构病5例,脓肿或血肿2例,脂肪瘤2例,肿块性质不能确定3例。针对12例患者我院采取手术进行治疗,其中肾切除5例、肿瘤剜除术7例,经随访后,患者无肿瘤复发或者转移的现象。
2.2病理检查
2.2.1冷冻切片 本组12例患者术中行冷冻切片10例,明确诊断肾AML 8例,1例误诊为肾细胞癌,1例误诊为肾高分化脂肪肉瘤。
2.2.2巨检 7例剜除标本中,有完整或部分包膜者2例,其余均无包膜,5例肾切除标本中,肿瘤位于肾上极2例,肾下极3例,有包膜3例,其中有2例侵入肾实质;共有14个肿瘤,直径为2.5~17 cm,肿瘤以原形居多,切面大多呈灰红色。
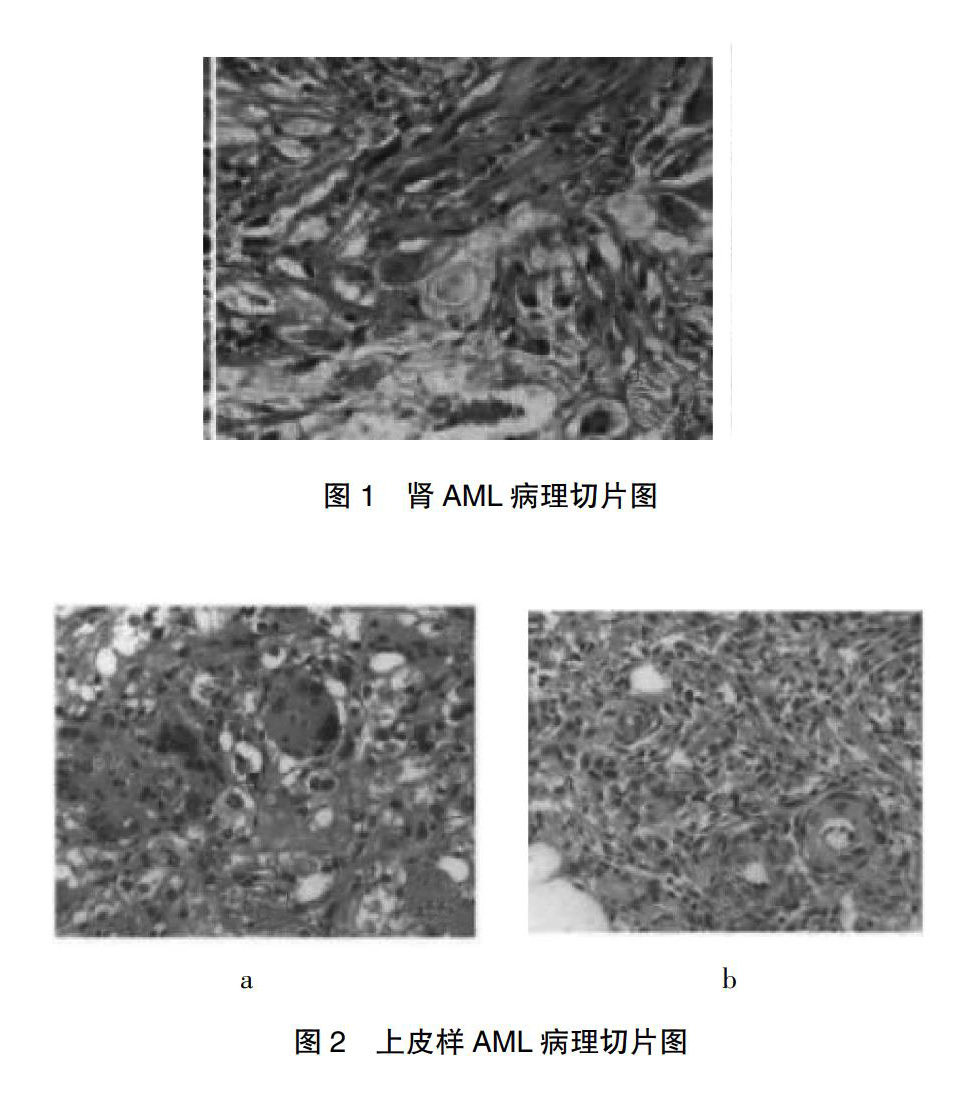
2.2.3镜检 经典的肾AML主要由梭形和胞质丰富的上皮样平滑肌细胞[3]、多少不等的成熟脂肪组织以及异常的厚壁血管三种成分混合构成(图1),而上皮样AML主要由增生的上皮样平滑肌细胞组成[4],为多边形,胞质透亮或嗜酸性,可有异型性,偶见核分裂象,并可见多核瘤巨细胞(图2),细胞呈片巢状或弥漫分布,可围绕不规则的厚壁血管呈套袖样排列(图2)[5]。部分病例肿瘤可见明显的出血坏死,并伴有炎细胞浸、泡沫细胞反应和含铁血黄素沉着等继发改变[6]。本组中有3例以上皮样细胞为主,细胞数量占肿瘤50%以上。
2.2.4免疫组化 12例肿瘤细胞Vimentin和HMB 45全部呈弥漫阳性;melan A和SMA大部分病例呈弥漫阳性,个别病例呈散在阳性(图3);CD117、CD34个别病例呈弱阳性;CK、EMA、S-100、CgA阴性。
3讨论
经典型AML主要由梭形和胞质丰富的上皮样平滑肌细胞[7]、多少不等的成熟脂肪组织以及异常的厚壁血管三种成分混合构成[8-9]。当肿瘤成分以上皮样细胞增生为主时,诊断上可能有困难,而多部位取材和仔细寻找经典的AML的区域或可以诊断,同时加做免疫组化染色,可以确诊[10-13]。AML应该与肾脏发生的肉瘤样癌、高分化脂肪肉瘤、上皮样型平滑肌肉瘤、嗜酸细胞腺瘤、副节瘤、胃肠道外间质瘤等相鉴别[14]。当AML以上皮样细胞为主时,呈片巢状排列,并可有瘤巨细胞出现,此时,和肉瘤样癌形态学上接近,后者CK和EMA为阳性,HMB 45、melan A为阴性。本组中1例冷冻切片误为肾细胞癌,后经石蜡病理和免疫组化证实为EAML。当肿瘤以脂肪组织成分为主时[14],易误诊为高分化脂肪肉瘤。免疫组化后者S-100(+),而HMB 45、melan A、SMA常为阴性,有助于鉴别[15]。本组中有1例也是经石蜡病理和免疫组化证实为肾上皮样血管平滑肌脂肪瘤(EAML)。而上皮样型平滑肌肉瘤、嗜酸细胞腺瘤[16]、副节瘤、胃肠道外间质瘤等都需要仔细寻找经典型AML的区域,同时加做免疫组化染色,可以与之辨别。
AML一般为良性肿瘤,无恶性转移的现象[15],但是确有AML发生转移的报道,主要在肝、肺、腹膜后等部位[16],而近年来的研究发现,EAML与经典型AML相比,在形态学和生物学行为上存在差异,以往报道的转移病例,多与此亚型病例有关[17]。本组12例中,有3例EAML,占比25%,其体积均较大,异型性明显,但在随访过程中,并未发现有复发和转移。目前对于AML的恶性诊断标准尚无统一认识,但是,有明显的细胞多形性,核分裂活跃和片状坏死者生物学上具有恶性潜能,而诊断恶性AML唯一可接受的标准是远处转移。
进行诊断的12例肾AML患者中,年龄在31~57岁,男女之比为1:3,与文献报道基本一致[6]。而患者均未合并结节性硬化症(TSC)。其中血尿、肿块、腰部酸痛为肾AML的主要临床症状。本组患者首发症状为腰部不适、胀痛7例,体检发现肿块5例,肉眼血尿1例。由于三种成分在肿瘤组织学中具有较大差异,且在影像学中容易误诊,在术前诊断的准确率为41.67%,确诊仍需依靠病理检查。
组织病理学,其EAML的定义与上皮样成分在肿瘤中占比相关,当上皮样成分<10%则定义为EAML,此说法尚存在争议,本研究报道的上皮样成分平均占50%以上,瘤细胞围绕血管呈血管周上皮样细胞排列,可定义为EAML[18]。
免疫组化,其EAML瘤细胞SMA、melan A及HMB 45均为阳性,其CK 7、AE 1/AE 3、CAM 5.2及EMA均为阴性、S-100蛋白表达不一,本组12例均诊断为肿瘤细胞Vimentin和HMB 45全部呈弥漫阳性;melan A和SMA大部分病例呈弥漫阳性,个别病例呈散在阳性,须考虑为黑色素瘤,其余免疫表型与报道基本一致[19]。
鉴别诊断,其EAML需与恶性黑色素瘤、副神经节瘤、高级别RCC等肿瘤进行鉴别,其免疫组化可对鉴别诊断结果有积极意义。①RCC[20]:当EAML中脂肪水平较低时,其影像学与ECC难以区分,于镜下上皮样细胞质透明时,且AML成分不明显,会误诊为RCC,其黑色素标记为阴性,阳性为免疫组化上皮性标记。②横纹肌肉瘤或平滑肌:肌源性标记desmin、SMA及MG为阳性,然而黑色素标记为阴性,可予以鉴别。③黑色素瘤:其标记及S-100均为阳性,阴性为平滑肌标记。④嗜酸细胞腺瘤:该肿瘤为嗜酸细胞组成,具有罕见核分现象,无坏死、出血等现象,于电镜下观察呈基底样褶变,其免疫花瘤细胞CK 8及EAML为阳性,且SMA、HMB 45、vimentin为阴性。
大多数AML呈良性经过,予以手术后极少复发,但肿瘤随着时间而增大,患者死于腹膜后大出血概率较高,而出血与否与患者的瘤体大小有直接关系,有学者表示,其肿瘤<4 cm时,症状轻微或无症状时的AML可密切随访观察,而肿瘤直径>4 cm时且伴随明显症状,须予以外科手术治疗。
肾AML治疗以手术切除为首选,经典型肾AML属良性肿瘤,术后很少复发和转移。而当EAML肿瘤中出现坏死、核分裂象、细胞的异型性和肾外扩散时,提示预后不佳。我院对于8例AML进行随访,时间为8~75个月,未发现有肿瘤复发和转移的现象,但仍需要对其进行长期的观察。
[参考文献]
[1]王安群,季语祝,杨永红.肾血管平滑肌脂肪瘤临床病理分析[J].现代肿瘤医学,2015,23(16):2359-2361.
[2]李明,王颖,卜仁戈,等.肾上皮样血管平滑肌脂肪瘤临床病理分析[J].国际泌尿系统杂志,2015,35(2):230-233.
[3]朱音,赵明.肾上皮样血管平滑肌脂肪瘤3例的临床病理分析[J].中国现代医生,2012,50(33):95-96.
[4]于世红.肾血管平滑肌脂肪瘤5例临床病理分析[J].当代医学,2013,19(3):15-16.
[5]杨琳,冯晓莉,袁燕玲,等.肾血管平滑肌脂肪瘤120例临床病理分析[J].中国肿瘤临床与康复,2011,18(1):1-5.
[6]韩红花.肾上皮样血管平滑肌脂肪瘤冷冻病理误诊分析[J].中国现代药物应用,2011,5(21):39-40.
[7]邵恩明,尹玉,张超,等.肾血管周上皮样细胞肿瘤1例临床病理分析[J].实用肿瘤杂志,2016,31(2):185-187.
[8]罗厚丽,叶兆祥,李绪斌,等.乏脂性肾血管平滑肌脂肪瘤与非透明细胞肾癌的多层CT鉴别诊断[J].临床放射学杂志,2016,35(4):575-579.
[9]余兴维,肖泽文,郭炬,等.肾上皮样血管平滑肌脂肪瘤2例报告[J].现代泌尿外科杂志,2016,21(3):243-244.
[10]张世蕾,朱建善.肺腺癌转移至肾血管平滑肌脂肪瘤临床病理观察[J].诊断病理学杂志,2016,23(3):225-226.
[11]刘翔,俞咏梅.不典型肾血管平滑肌脂肪瘤的影像学诊断[J].皖南医学院学报,2016,35(1):75-78.
[9]王增利,孙伍柒,孙飞达.肾毛细血管瘤1例报告[J].现代泌尿外科杂志,2016,21(2):83-83.
[10]朱华平,李立宇.恶性肾血管周细胞瘤误诊为肾血管平滑肌脂肪瘤[J].临床误诊误治,2016,29(1):45-46.
[11]陆文宝.肾上皮样血管平滑肌脂肪瘤的研究现状[J].实用临床医学(江西),2015,16(12):103-105.
[12]詹安娜.肾上皮样血管平滑肌脂肪瘤1例[J].当代医学,2015,21(36):85-86.
[13]周硕,林美福,陈文新,等.少脂肪肾血管平滑肌脂肪瘤的CT表现[J].包头医学院学报,2015,31(12):16-17.
[14]梁长宇,毛明伟,石华亮.CT血管成像诊断肾动脉狭窄的Meta分析[J].检验医学与临床,2015,12(22):3351-3353.
[15]王锐,邢力永,高靖达.单例成人肾血管平滑肌腺样瘤诊疗分析[J].临床泌尿外科杂志,2015,30(11):993-995.
[16]刘凯.肾乏脂肪血管平滑肌脂肪瘤与肾癌亚型的CT鉴别诊断[J].中国CT和MRI杂志,2015,13(11):74-78.
[18]赵国礼,杨学东,王晓熙等.肾血管平滑肌脂肪瘤的CT表现[J].海军医学杂志,2015,36(5):421-422.
[19]王珏儒[1].肝脏血管平滑肌脂肪瘤的诊治进展[J].医学综述,2011,17(12):1826-1828.
[20]何志嵩.结节性硬化症相关肾血管平滑肌脂肪瘤的诊断和治疗进展[J].中华泌尿外科杂志,2013,34(11):874-875.
(收稿日期:2016-07-01 本文编辑:顾雪菲)