打开文本图片集
摘要 以认知发展理论、有效教学理论为指导,进行高中“氧化还原反应”的有效性教学策略的建构。实践研究表明,这一构建的教学策略是行之有效的。
关键词 认知发展理论;有效教学理论;化学核心观念;氧化还原反应
“氧化还原反应”这一高中化学教学内容主要是由本质与特征、守恒问题、发生形式、实际价值这四个部分组成。2004年开始高中新课程标准实验教科书改革,2014年苏教版化学1中氧化还原反应这一教学内容安排发生了如下变化:将氧化还原反应配平从专题4(第二单元生产生活中的含氮化合物第三框图硝酸的性质资料卡)移到专题2(氯、溴、碘及其化合物第三框图氧化还原反应资料卡)中。但多年的教学经验告诉我们,应该对新课程下的“氧化还原反应”相关知识在学生认知发展过程中的位置、功能及价值进行研究,才能合理地安排教学活动,帮助学生化解困难,实现有效教学。
一、研究背景
认知发展理论认为:高中生的抽象记忆迅速发展,具体形象记忆下降;教学活动是教师根据学生认知发展水平,逐步帮助学生理解学科核心内容和价值,应用学科核心观念解决实际问题的过程。
新课程背景下,高中学生的化学认知发展水平可分为四个阶梯。第一阶梯为显性知识,即学生对元素化合物知识的认知。第二阶梯为探究化学核心主题活动,是促使学生理解化学核心概念、原理的活动。第三阶梯为隐性价值,指的是学生逐渐建构的化学核心观念。第四阶梯为核心价值,即学生最终理解与应用化学价值、绿色化学、STSE的理念。化学核心观念在第一、二阶梯中逐渐建构的(见表1),是实现学生理解与应用化学价值、绿色化学、STSE的理念的关键因素。
因此,以化学核心观念的建构为本的高中化学教学,是促使学生脱离背诵、记忆的学习模式,是促进学生的认知得到转变、认知方式得到发展的有效教学活动。
二、“氧化还原反应”认知发展研究
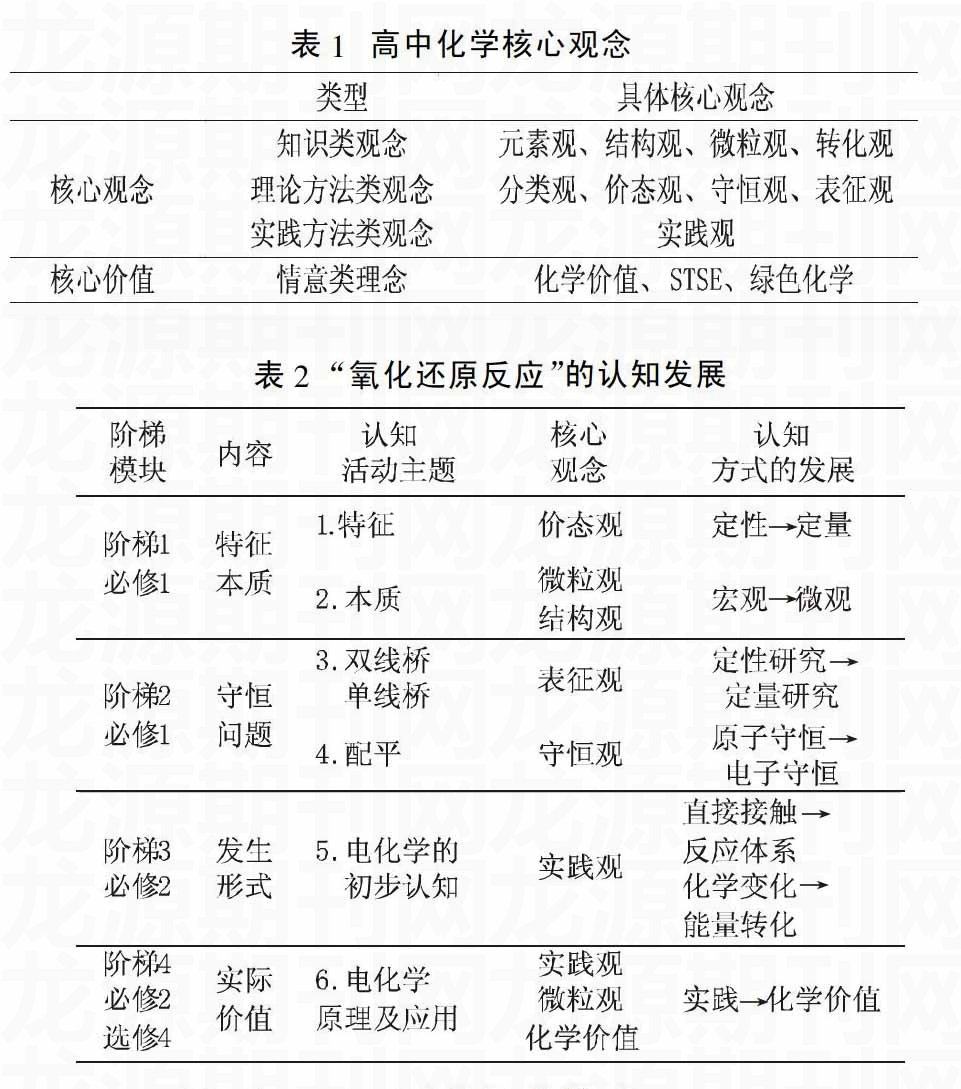
以苏教版为例,“氧化还原反应”的六个认知活动依次为:特征、本质、“双线桥、单线桥”、氧化还原反应的配平、初识原电池与电解池装置、理解原电池与电解池原理及应用。
对“氧化还原反应”教学中渗透的化学核心观念、学生认知方式的发展进行了研究,并梳理了“氧化还原反应”认知发展阶梯、核心观念、认知方式发展的关系。(见表2)
三、“氧化还原反应”教学策略
基于以上教育教学理论与教学实践的研究,建构以化学核心观念为本的“氧化还原反应”教学策略是:在“氧化还原反应”的学生认知阶梯活动中,层层递进建构化学核心观念,开展以“学生运用化学核心观念分析化学问题”为认知主题的教学活动,促使学生理解“氧化还原反应”相关知识,掌握常见物质的氧化性、还原性和电化学原理,最终理解“氧化还原反应”的实际价值,学会应用“氧化还原反应”原理解决实际问题。(见表3)
1.“氧化剂、还原剂的特点”教学策略
建构基于“价态观、微粒观、结构观”发展“转化观、分类观”的认知方式为核心理念的教学策略。开展以“氧化剂、还原剂的特点”为认知主题的活动,促使学生理解“氧化还原反应”的本质与特征;组织学生应用“价态观”对物质的氧化性与还原性、化学反应类型进行判断的教学活动,培养学生应用化学核心观念看待化学问题能力,初步认知氧化还原反应在生产、生活中的重要意义。(见表4)
2.“氧化剂、还原剂定量关系”的教学策略
建构基于“表征观”,发展“守恒观”的认知维度为核心理念的教学策略。开展以“氧化剂、还原剂的定量关系”为认知主题的活动,促使学生理解“氧化还原反应”的电子转移情况、电子守恒问题;通过认知“双线桥、单线桥”、氧化还原反应的配平活动,促使学生学会应用“守恒观”来进行氧化剂、还原剂定量分析。(见表5)
3.初步理解化学价值的教学策略
建构开拓“实践观”的视野,初步理解氧化还原反应的价值为核心理念的教学策略。开展以“氧化剂、还原剂发生反应的形式”为认知主题的活动,通过“直接接触”、“电极反应”、“通电条件下”三种方式发生“氧化还原反应”实验的见证,发展学生对氧化还原反应的认知方式(见表6),初步认知化学能与电能相互转换的装置——“原电池、电解池”,初步理解氧化还原反应的实际价值。
在教学活动中,开展以“用化学方法产生电能”为探究主题的活动,以化学电源为教学的实物场景,让学生进行自主设计实验和验证实验;开展以“将电能转化为化学能”为探究主题的活动,以充电电源为教学的实物场景,学生自主设计实验思路,与验证实验的活动;紧密联系生产、科技的实际,介绍电解法制取金属、铜的电解精炼等应用,促使学生初步理解在生产、科技中在通电条件下发生“氧化还原反应”的实际价值。
4.“实验探究,提升能力”的教学策略
建构“通过实验探究,提升解决化学问题的能力”为核心理念的教学策略。开展以“溶液中微粒的氧化性、还原性的强弱的探究”为认知主题的活动,通过进一步探究原电池、电解池原理及应用,促使学生掌握氧化剂、还原剂实际发生反应的原理,理解氧化还原反应原理在生活、生产、科技、环保中的价值。(见表7)
以课外实验形式开展金属电化学腐蚀实验,结合铜锌(稀硫酸)原电池,引导学生发现金属腐蚀与环境(空气中含有氧气、二氧化碳等物质)有着紧密的联系。理解溶解在中性与碱性溶液中的氧气是金属发生吸氧腐蚀的重要因素,在酸性溶液中氢离子的氧化性是析氢腐蚀的重要因素。初步了解溶液中氢离子浓度的大小影响着其氧化性强弱。通过练习与实践,学生掌握了常见微粒的氧化性的强弱关系【H+(水)﹤O2﹤H+(酸)﹤Cu2+﹤Ag+】及牺牲阳极的阴极保护法来防止金属腐蚀的方法。
以锌铜原电池实验中 “锌极表面有气体”为探讨主题,引发学生探讨电子发生了流失,发现了该原电池有漏电现象,引入盐桥概念。理解原电池结构研究的价值,有利于提高能源的利用率。
以甲烷、甲醇、汽油三种燃料电池的背景为研究材料,引导学生发现阳极发生反应的不同,促使学生发现电极反应还要考虑其他电解质是否参加问题,开阔了学生实践探索的思路。
开展电解氯化铜溶液、硫酸溶液、氯化钠溶液的活动,促使学生发现电极对离子放电有一定的选择性,建立了物质(微粒)氧化性、还原性强弱规律, 理解电解溶液实际电解的物质可以分为三种——水、电解质、混 合型。
在探究充电电池、电镀、精制金属等活动中理解金属防腐(外加电源的阴极保护法)、电解法冶炼金属的 原理。
四、实践意义
教学实践后,大多学生表示理解了价态、结构、类别(性质)、化学变化之间紧密的联系,“双线桥、单线桥”是“氧化还原反应”本质与守恒的表征,掌握了“氧化还原反应”相关概念的内涵与外延,化学知识变得更加系统;学习方式从记忆与堆积知识,渐渐转化为以化学核心观念来引导解决化学问题的方式;理解研究物质的氧化性、还原性的实际价值。教师的教学方式也从知识传授向发展学生认识方式改变,教学思绪更加清晰,提高了课堂教学实效性。
(责任编辑:张贤金)